
















































































































I 简介
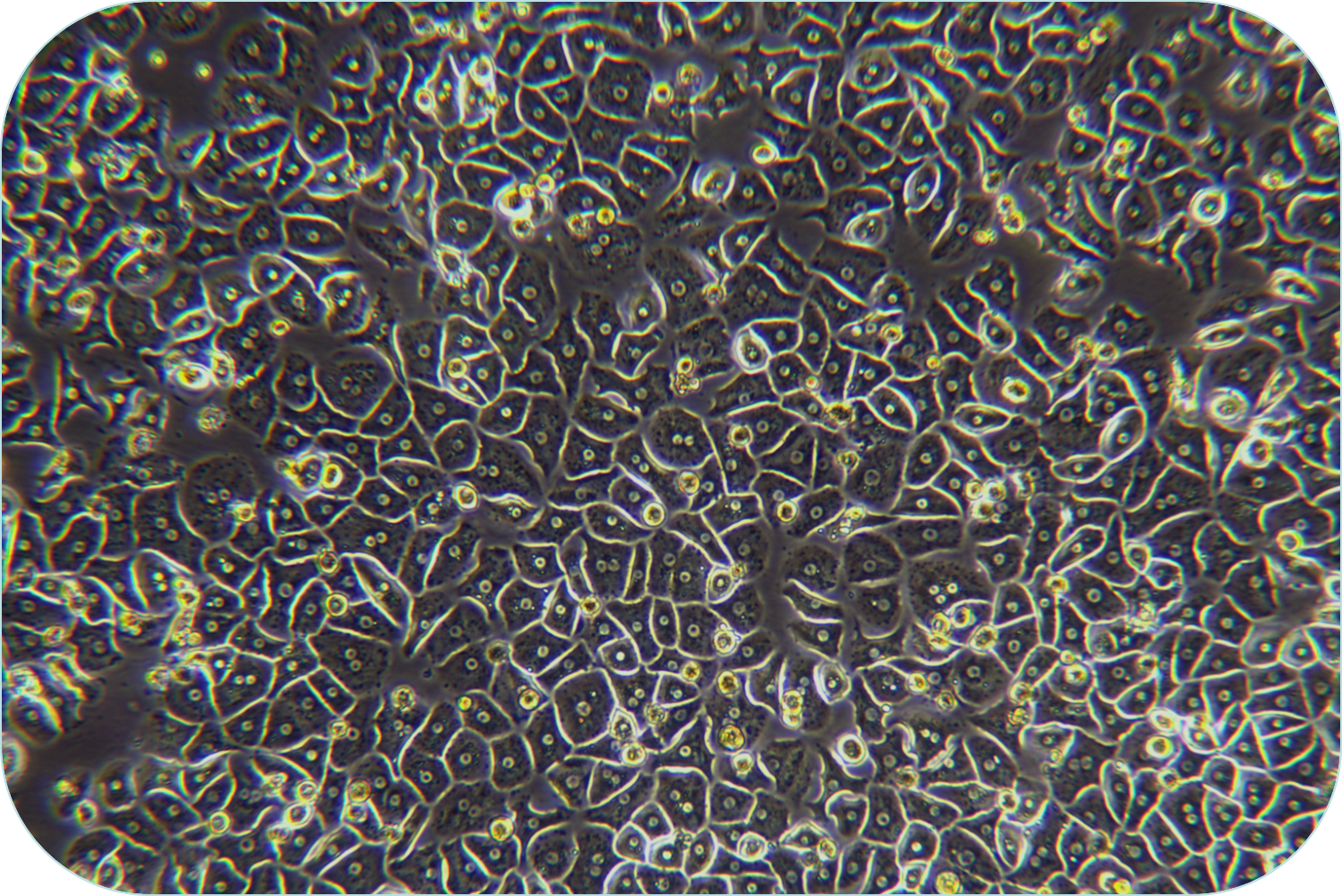
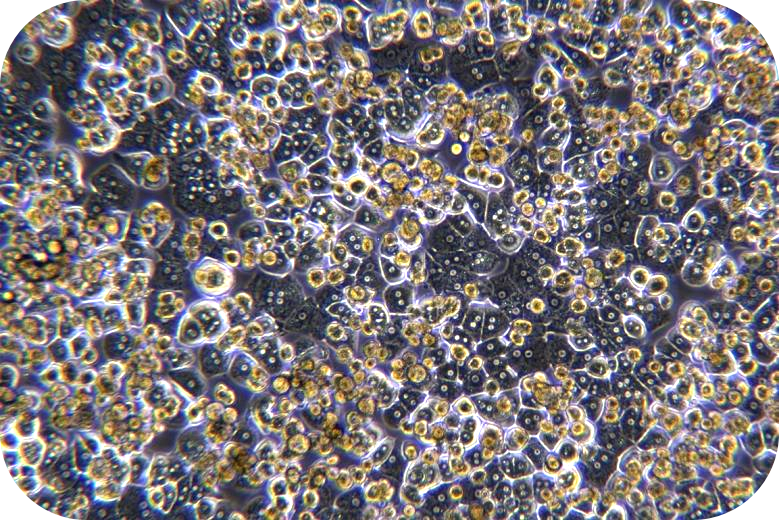
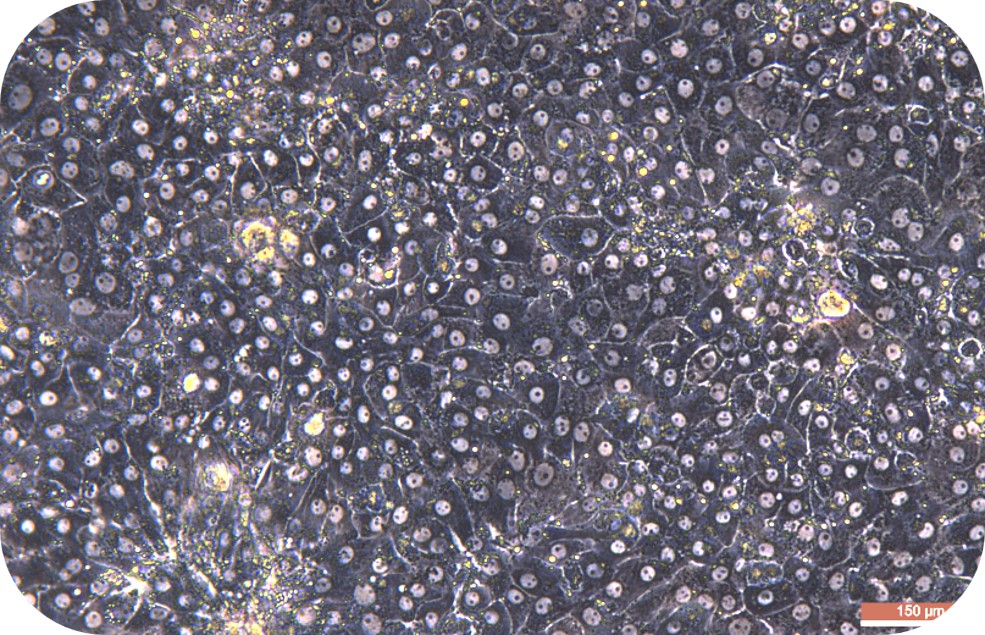
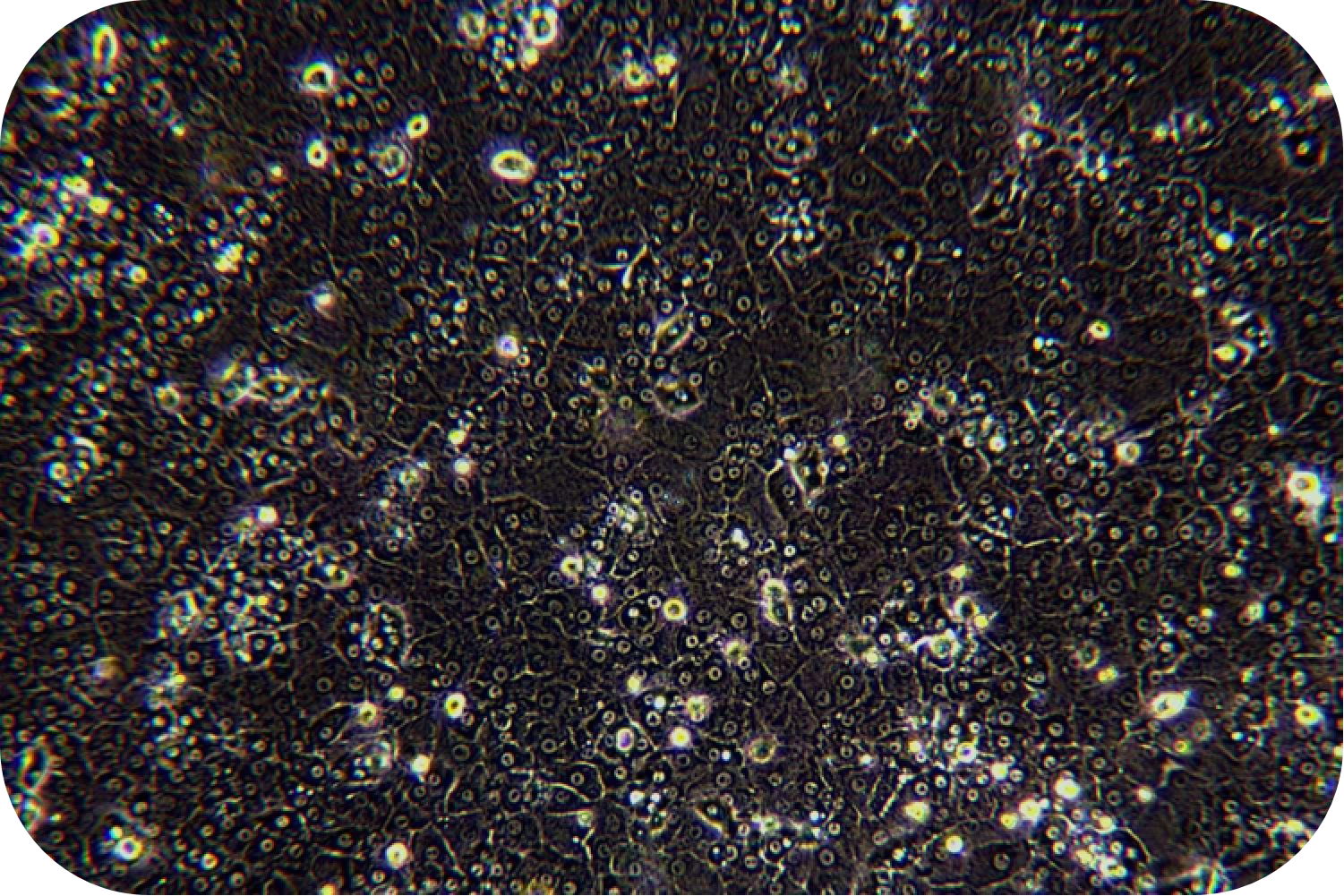
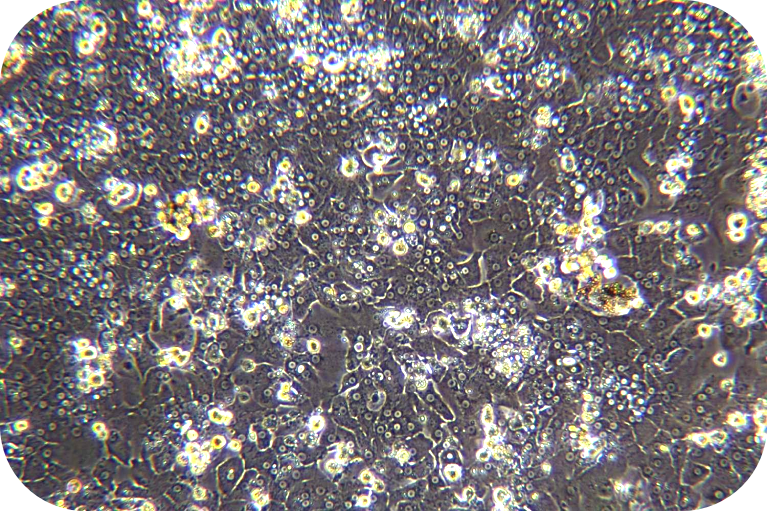
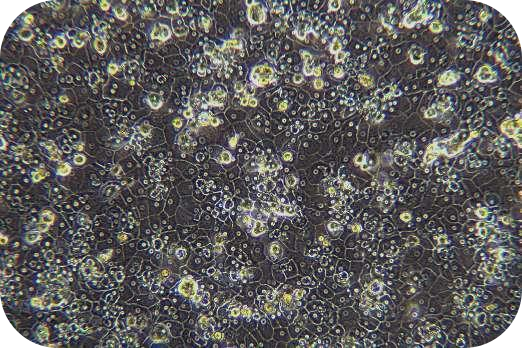
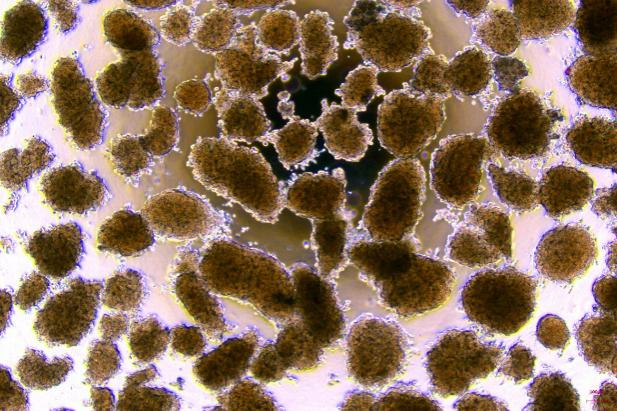
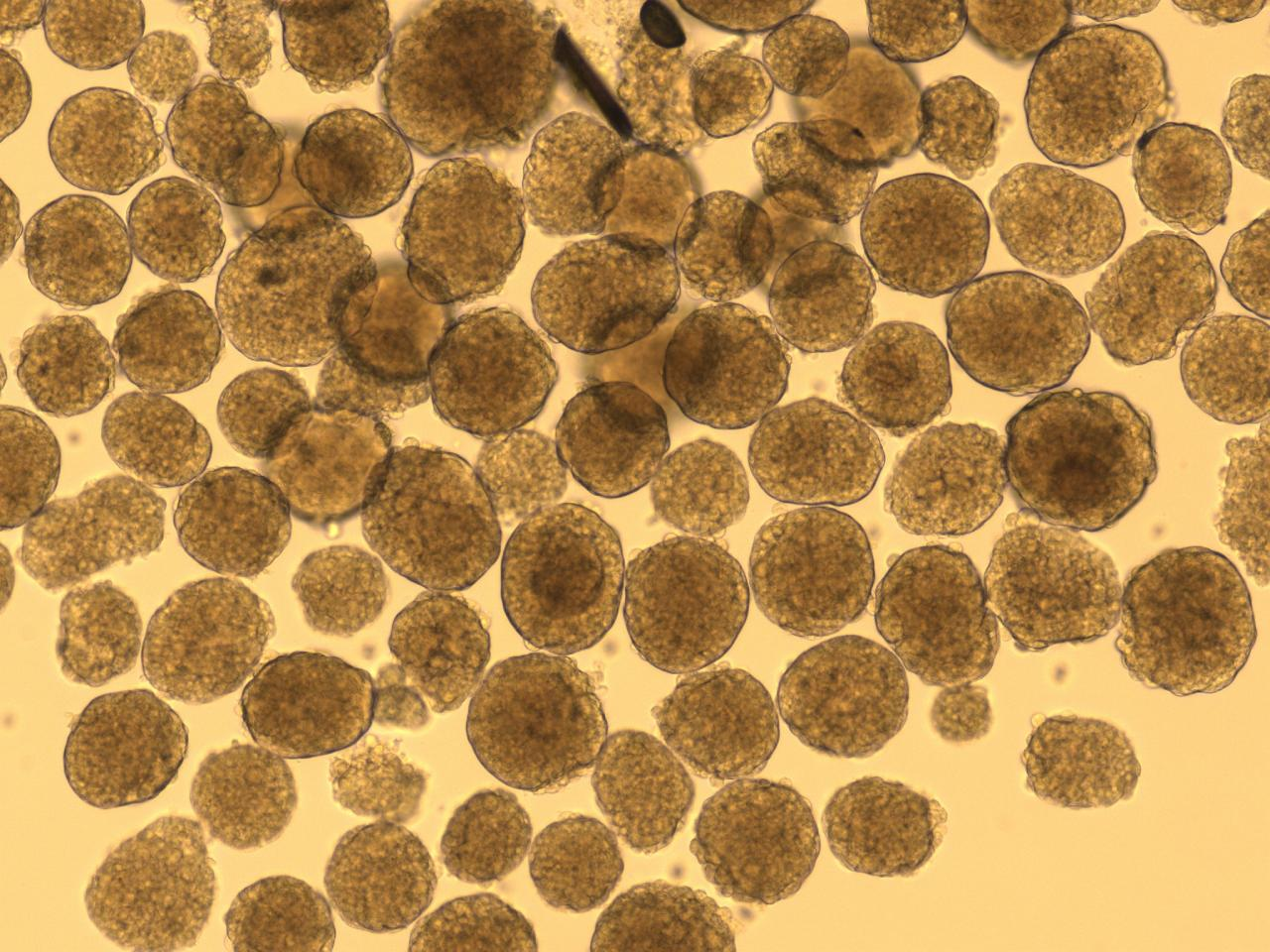
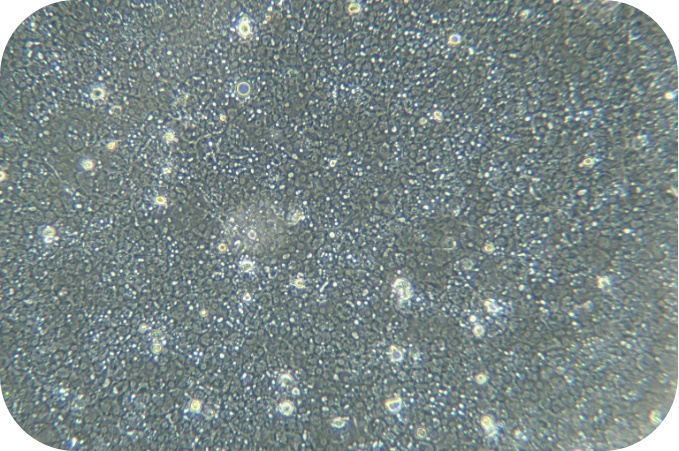
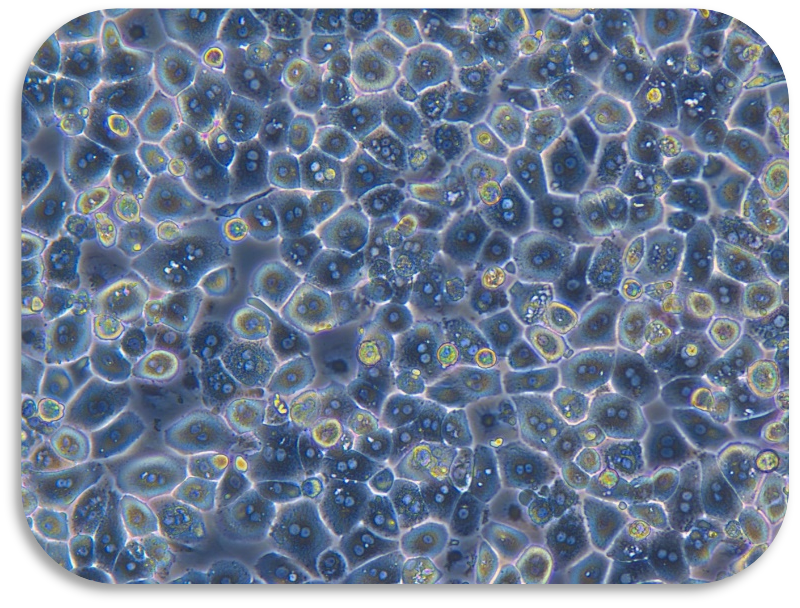
胶原蛋白是猪皮的主要组成部分,具有独特的生化性质和生理功能,具有良好的细胞适应性、细胞增殖、促进伤口愈合,促进骨的形成、增强皮肤代谢,可广泛使用在医疗、美容和细胞培养方面。我们的产品是从猪皮中提取分离,在万级实验室中经过多道工序提纯获得的,保持了胶原蛋白的生物活性。经测试,本产品pH调至中性后可成胶,可用于多种原代细胞的细胞培养,例如肝细胞、血管内皮细胞、间充质干细胞、胰岛beta等细胞。
II 试剂与耗材
—胶原母液(本产品Cat: LV-collagen004)
—超纯水
—醋酸母液
—0.22μm滤膜及50mL一次性注射器
—氢氧化钠(Sigma; Cat:S5881-500G)
—移液枪及枪头
—培养板/皿/瓶
—生物安全柜
—37℃/5%CO2培养箱
III 包被步骤
1.在生物安全柜中,将5mL醋酸母液加入到1L无菌水中配制成为醋酸工作液。
2.加入I型猪皮胶原母液,使终浓度为50μg/mL,即每100mL醋酸工作液中加入5mg胶原蛋白(对应胶原母液体积为V=5mg/10mg/mL=0.5mL),4℃保存待用(不超过3个月)。
3.将胶原工作液以大于/等于5μg/cm2的包被量加入到需要包被处理的培养板/皿/瓶中,通常情况下,加入工作液为推荐培养基(见附表)使用体积的60%,如12孔板的培养基推荐使用体积为1mL,加入0.6mL胶原工作液即可达到饱和。
4.生物安全柜中,常温孵育1h。延长包被时间至3小时,对后续细胞培养没有影响。
5.将胶原工作液吸出,生物安全柜中自然晾干,封口膜封口,4℃保存不超过6个月。
6.接种细胞前,胶原包被培养板/皿/瓶需PBS或培养基清洗一次,以去除残留的醋酸。
IV 成胶步骤
1.准备1M NaOH、10×PBS或10×DMEM以及超纯水,过滤除菌后于冰上预冷。
2.成胶溶液的各成分添加量与配置方法:
2.1 10×PBS或10×DMEM的添加量为最终体积的1/10mL。
2.2 胶原添加量为:
终体积×胶原终浓度(mg/ml) |
=胶原添加量(mL) |
胶原母液浓度(10mg/mL) |
2.3 NaOH添加量为:
胶原添加量×0.015μL=1M NaOH添加量(μL)
2.4 灭菌水的添加量:
终体积-胶原添加体积-NaOH添加体积-10×PBS或10×DMEM体积=超纯水添加量(mL)
3.将10×PBS或10×DMEM和NaOH溶液以及超纯水混合均匀至于冰上。
4.将胶原加入混合液中充分混匀,然后立即使用。
5.使用时可根据实验需求直接铺板,放入37℃孵育30min待胶凝固即可使用。
Ⅵ 参考文献
(1) Biofunctionalization of porcine-derived collagen matrices with platelet rich fibrin: influence on angiogenesis in vitro and in vivo[J]. Clinical Oral Investigations:1-12.
特殊说明
1.本产品为冷藏发货,收货后可能为部分液体或者液体状态(确保仍然低温),属于正常状态。
2.I型猪皮胶原母液储存在-20℃,避免多次冻融,建议根据需求量进行分装后冻存。
3.本产品为无菌液体,请放心使用,无需过滤。
4.胶原工作液可重复利用2-3次,但需避免因多次包被而造成可能的污染,如怀疑存在污染,请立即放弃使用。
5.成胶时只需把终溶液调成中性即可,添加NaOH的量可能会有误差,可和水的添加量进行调整。
6.各成分溶液添加混合顺序可互换,但是要保证不可将NaOH加入胶原溶液中,只可以将胶原溶液加到NaOH溶液中,避免出现因NaOH不能迅速混匀而产生局部凝胶的情况。
特殊说明
1. 本产品为冷藏发货,收货后可能为部分液体或者液体状态(确保仍然低温),属于正常状态。
2. I型猪皮胶原母液储存在-20℃,避免多次冻融,建议根据需求量进行分装后冻存。
3. 本产品为无菌液体,请放心使用,无需过滤。
4. 胶原工作液可重复利用2-3次,但需避免因多次包被而造成可能的污染,如怀疑存在污染,请立即放弃使用。
5. 成胶时只需把终溶液调成中性即可,添加NaOH的量可能会有误差,可和水的添加量进行调整。
6. 各成分溶液添加混合顺序可互换,但是要保证不可将NaOH加入胶原溶液中,只可以将胶原溶液加到NaOH溶液中,避免出现因NaOH不能迅速混匀而产生局部凝胶的情况。
Ⅴ 联系方式
公司电话:0755-28284050
技术支持:19902901483(周博士)